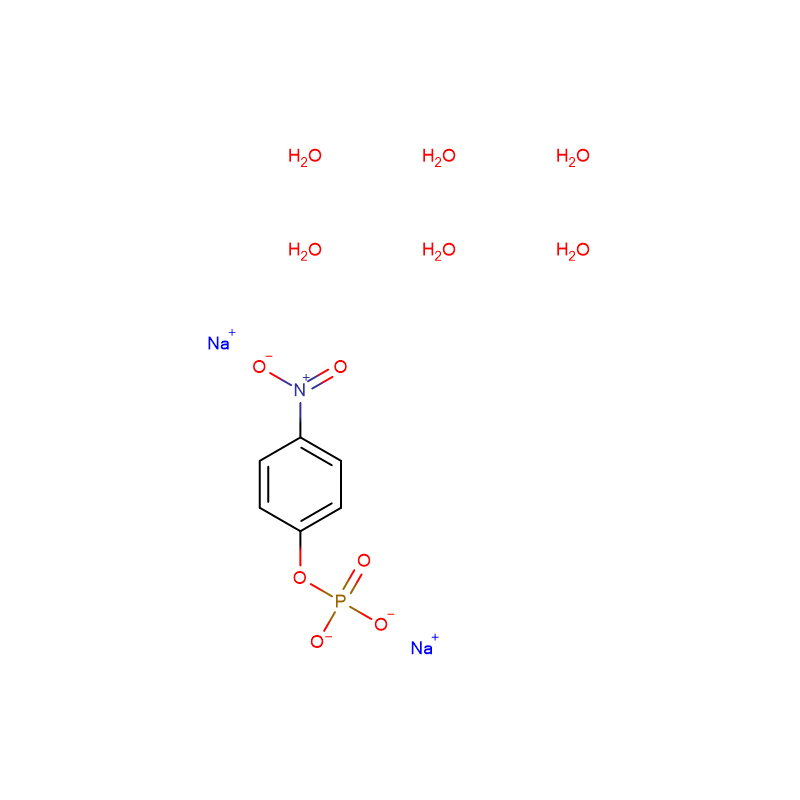
4-Nitrofenylfosfat dinatriumsalt 6-hydrat CAS:333338-18-4 hvitt til blekgult pulver
| Katalognummer | XD90511 |
| Produktnavn | 4-Nitrofenylfosfat dinatriumsalt 6-hydrat |
| CAS | 333338-18-4 |
| Molekylær formel | C6H16NNa2O12P |
| Molekylær vekt | 371.142 |
| Oppbevaringsdetaljer | Omgivende |
| Harmonisert tariffkode | 29199000 |
Produkt spesifikasjon
| Utseende | hvit til blekgul |
| Assay | 99 % |
Over 70 % av lavgradige gliomer bærer en heterozygot R132H-mutasjon i genet som koder for isocitrat dehydrogenase 1 (IDH1).Dette gir enzymet den nye evnen til å omdanne α-ketoglutarat til 2-hydroksiglutarat, noe som til slutt fører til tumorigenese.Den viktigste kilden til produksjon av 2-hydroksiglutarat er glutamin, som ved kreft også er en kilde for trikarboksylsyresyklus (TCA) anaplerose.En alternativ kilde til anaplerose er pyruvatfluks via pyruvatkarboksylase (PC), som er en vanlig vei i normale astrocytter.Målet med denne studien var å finne ut om PC tjener som en kilde til TCA-anaplerose i IDH1 mutante celler hvor glutamin brukes til 2-hydroksiglutarat produksjon. Udødeliggjorte normale humane astrocytter konstruert for å uttrykke heterozygot mutant IDH1 eller villtype IDH1 ble undersøkt.Fluks av pyruvat via PC og via pyruvatdehydrogenase (PDH) ble bestemt ved å bruke magnetisk resonansspektroskopi for å undersøke merkingen av [2-¹³C]glukoseavledet ¹³C-merket ledet glutamat og glutamin.Aktivitetsanalyser, RT-PCR og western blotting ble brukt for å undersøke ekspresjonen og aktiviteten til relevante enzymer.Cancer Genome Atlas (TCGA)-data ble analysert for å vurdere ekspresjonen av enzymer i humane gliomprøver. Sammenlignet med villtypeceller økte mutante IDH1-celler betydelig fraksjonell fluks gjennom PC.Dette var assosiert med en betydelig økning i PC-aktivitet og uttrykk.Samtidig reduserte PDH-aktiviteten betydelig, sannsynligvis mediert av signifikant økt hemmende PDH-fosforylering av PDH-kinase 3. I samsvar med observasjonen i celler indikerte analyse av TCGA-data en signifikant økning i PC-ekspresjon i mutant IDH-uttrykkende humane gliomprøver sammenlignet med vill- type IDH. Våre funn tyder på at endringer i PC og PDH kan være en viktig del av cellulær tilpasning til IDH1-mutasjonen og kan tjene som potensielle terapeutiske mål.