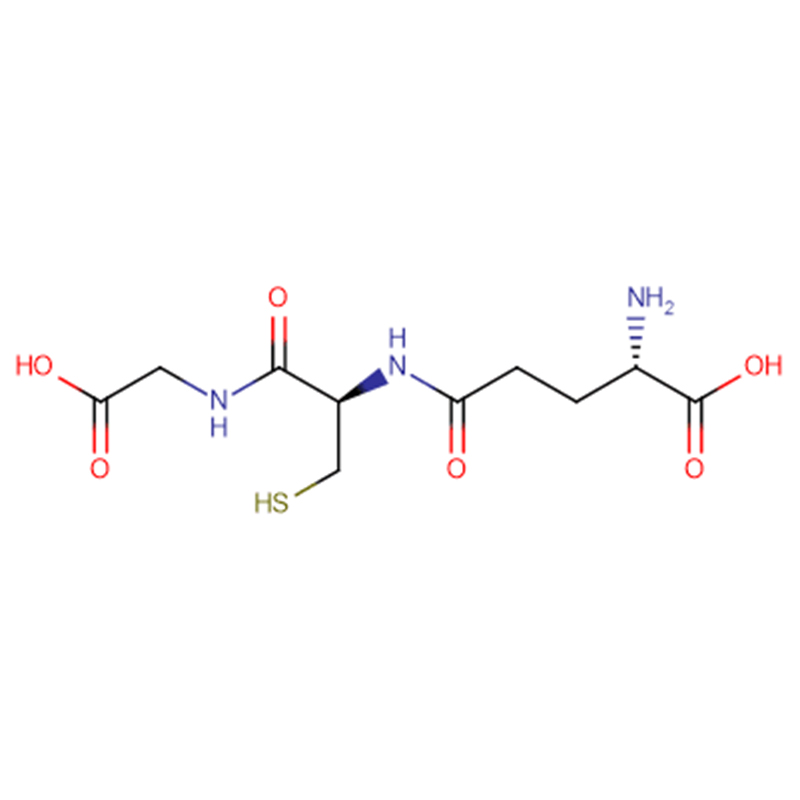
GSH Cas: 70-18-8 98% Hvitt krystallinsk pulver
| Katalognummer | XD90227 |
| Produktnavn | GSH |
| CAS | 70-18-8 |
| Molekylær formel | C10H17N3O6S |
| Molekylær vekt | 307.323 |
| Oppbevaringsdetaljer | 2 til 8 °C |
| Harmonisert tariffkode | 29309098 |
Produkt spesifikasjon
| Produkt spesifikasjon | |
| Smeltepunkt | 185°C |
| Karakter | Pharma karakter |
| Tungmetaller | 10 ppm maks |
| Arsenikk | 2 ppm maks |
| Identifikasjon | IR : Ligner på referansespekteret |
| Tap ved tørking | 0,5 % maks |
| Lager temperatur | +20 °C |
| Molekylær vekt | 612,63 |
| Assay | 98,0 % min |
| Optisk rotasjon | -15,5°- -17,5 grader |
| Rester ved tenning | 0,1 % maks |
| Klarhet i løsningen | Klar og fargeløs |
| Utseende | Hvitt krystallinsk pulver |
| Beslektet stoff | Totalt: maks. 2,0 %, GSSG: maks. 1,5 % |
ORF45-proteinet til Kaposis sarkom-assosierte herpesvirus (KSHV) er et gammaherpesvirus-spesifikt umiddelbart-tidlig tegumentprotein.Våre tidligere studier har avslørt dens avgjørende roller i både tidlige og sene stadier av KSHV-infeksjon.I denne studien undersøkte vi interaktomet til ORF45 ved å bruke et panel av monoklonale antistoffer.I tillegg til de tidligere identifiserte ekstracellulær regulert kinase (ERK) og p90 ribosomal S6 kinase (RSK) proteiner, fant vi flere andre samrensede proteiner, inkludert fremtredende på ~38 kDa og ~130 kDa.Massespektrometri avslørte at 38-kDa-proteinet er viralt ORF33 og 130-kDa-proteinet er cellulær USP7 (ubiquitin-spesifikk protease 7).Vi kartla det ORF33-bindende domenet til de svært konserverte karboksylterminale 19 aminosyrene (aa) til ORF45 og det USP7-bindende domenet til det rapporterte konsensusmotivet i den sentrale regionen av ORF45.Ved å bruke immunfluorescensfarging observerte vi kolokalisering av ORF45 med ORF33 eller USP7 både under transfekterte forhold og i KSHV-infiserte celler.Dessuten la vi merke til ORF45-avhengig relokalisering av en del av ORF33/USP7 fra kjernen til cytoplasmaet.Vi fant at ORF45 forårsaket en økning i ORF33-proteinakkumulering som ble opphevet hvis enten ORF33- eller USP7-bindende domene i ORF45 ble slettet.Videre reduserte sletting av den konserverte karboksylterminalen til ORF45 i KSHV-genomet drastisk nivået av ORF33-protein i KSHV-infiserte celler og opphevet produksjonen av avkomsvirioner.Samlet avslører resultatene våre ikke bare nye komponenter i ORF45-interaktomet, men viser også at interaksjonene mellom disse proteinene er avgjørende for KSHV-lytisk replikasjon. Kaposis sarkomassosierte herpesvirus (KSHV) er årsaken til flere kreftformer hos mennesker.KSHV ORF45 er et multifunksjonelt protein som kreves for KSHV lytisk replikasjon, men de nøyaktige mekanismene som ORF45 utfører sine kritiske funksjoner med er uklare.Våre tidligere studier avslørte at alt ORF45 pr otein i celler eksisterer i komplekser med høy molekylvekt.Vi forsøkte derfor å karakterisere interaktomet til ORF45 for å gi innsikt i dens roller under lytisk replikering.Ved å bruke et panel av monoklonale antistoffer undersøkte vi ORF45-interaktomet i KSHV-infiserte celler.Vi identifiserte to nye bindingspartnere til ORF45: det virale proteinet ORF33 og cellulær ubiquitin-spesifikk protease 7 (USP7).Vi demonstrerer videre at interaksjonen mellom ORF45 og ORF33 er avgjørende for effektiv produksjon av KSHV-viruspartikler, noe som antyder at den målrettede interferensen med denne interaksjonen kan representere en ny strategi for å hemme KSHV-lytisk replikasjon.