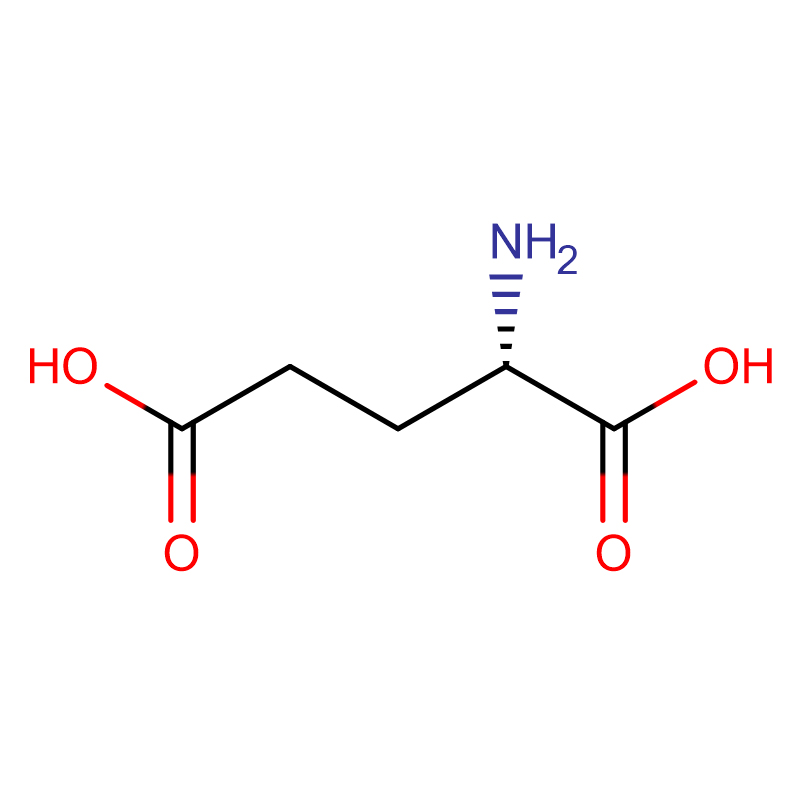
L-glutaminsyre CAS:56-86-0 99% hvitt pulver
| Katalognummer | XD90312 |
| Produktnavn | D-glutaminsyre |
| CAS | 56-86-0 |
| Molekylær formel | C5H9NO4 |
| Molekylær vekt | 147,13 |
| Oppbevaringsdetaljer | Omgivende |
| Harmonisert tariffkode | 29224200 |
Produkt spesifikasjon
| Utseende | Hvit krystall eller krystallinsk pulver |
| Assay | 99 % |
| Spesifikk rotasjon | +31,5 til +32,5° |
| pH | 3,0 til 3,5 |
| Tap ved tørking | 0,2 % maks |
| Jern | 10 ppm maks |
| AS2O3 | 1 ppm maks |
| Tungmetall (Pb) | 10 ppm maks |
| Ammonium | 0,02 % maks |
| Andre aminosyrer | <0,4 % |
| Klorid | 0,02 % maks. |
| Rester ved antennelse (sulfatert) | 0,1 % maks |
| Sulfat (som SO4) | 0,02 % maks |
EAAT2 glutamattransportøren, står for >90 % av hippocampus glutamatopptak.Selv om EAAT2 hovedsakelig uttrykkes i astrocytter, finnes ~10% av EAAT2-molekylene i aksonterminaler.Til tross for det lavere nivået av EAAT2-ekspresjon i glutamaterge terminaler, når hippocampusskiver inkuberes med lav konsentrasjon av d-aspartat (et EAAT2-substrat), akkumulerer aksonterminalene d-aspartat like raskt som astroglia.Dette innebærer et uforklarlig misforhold mellom fordelingen av EAAT2-protein og EAAT2-mediert transportaktivitet.En hypotese er at (1) heteroutveksling av internt substrat med eksternt substrat er betydelig raskere enn nettoopptak og (2) terminaler favoriserer heterobytte på grunn av høye nivåer av internt glutamat.Imidlertid er det foreløpig ukjent om heterobytte og opptak har lignende eller forskjellige hastigheter.For å løse dette problemet brukte vi et rekonstituert system for å sammenligne de relative hastighetene til de to prosessene hos rotter og mus.Nettoopptak var følsomt for endringer i membranpotensialet og ble stimulert av eksterne permeable anioner i samsvar med eksistensen av en ukoblet anionkonduktans.Ved å bruke sistnevnte demonstrerer vi også at hastigheten på heteroutveksling også avhenger av membranpotensialet.I tillegg tyder våre data ytterligere på tilstedeværelsen av en natriumlekkasje i EAAT2.Ved å inkorporere de nye funnene i vår forrige modell av glutamatopptak av EAAT2, spår vi at spenningsfølsomheten for utveksling er forårsaket av den spenningsavhengige tredje Na(+)-bindingen.Videre antyder både våre eksperimenter og simuleringer at de relative hastighetene for nettoopptak og heteroutveksling er sammenlignbare i EAAT2.