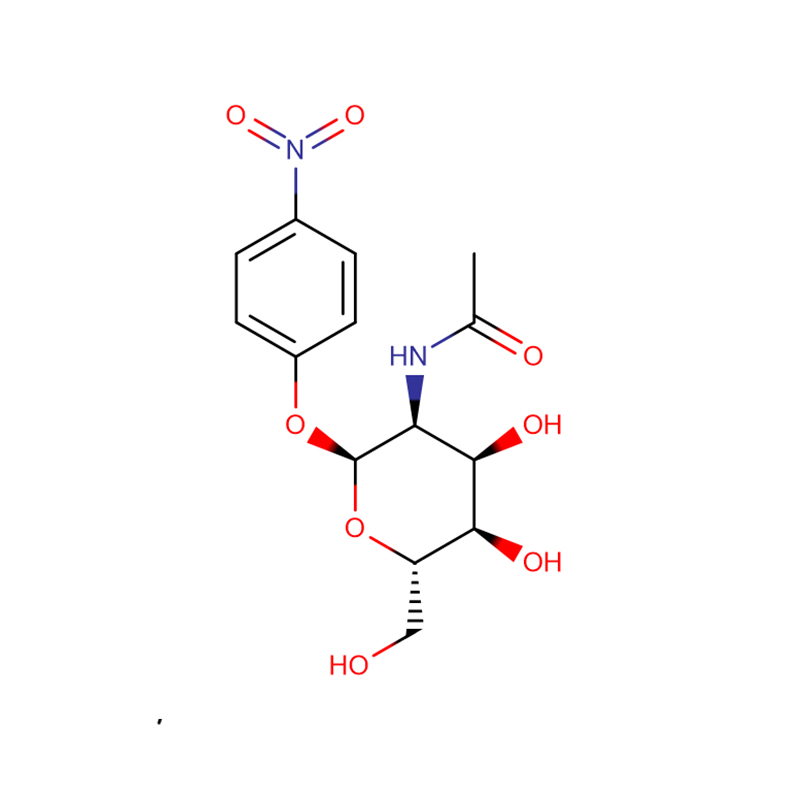
p-Nitrofenyl-aL-Fucopyranoside Cas:10231-84-2 Hvitt til blekgult krystallinsk pulver
| Katalognummer | XD90142 |
| Produktnavn | p-nitrofenyl-aL-fukopyranosid |
| CAS | 10231-84-2 |
| Molekylær formel | C12H15NO7 |
| Molekylær vekt | 285,25 |
| Oppbevaringsdetaljer | 2 til 8 °C |
| Harmonisert tariffkode | 29400000 |
Produkt spesifikasjon
| Utseende | Hvitt til blekgult krystallinsk pulver |
| Assay | 99 % |
| TLC | Enkelt sted |
| Renhets-HPLC | Min 98 % |
| Løselighet (1 % i vann) | Klar fargeløs løsning |
| Tetthet | 1,503±0,06 g/cm3 (20 ºC 760 Torr), |
| Smeltepunkt | 196-197 ºC |
| Kokepunkt | 515,4°Cat760mmHg |
| Flammepunkt | 265,5°C |
| Brytningsindeks | 1,623 |
LecA (PA-IL) er et cytotoksisk lektin og adhesin produsert av Pseudomonas aeruginosa som binder hydrofobe galaktosider med høy spesifisitet og affinitet.Ved å bruke en lecA-egfp translasjonsfusjon og immunoblotanalyse av den ekstracellulære biofilmmatrisen, viser vi at lecA uttrykkes i biofilmvokste celler.I statiske biofilmanalyser på både polystyren og rustfritt stål ble biofilmdybde og overflatedekning redusert ved mutasjon av lecA og forbedret i den LecA-overproduserende stammen PAO-P47.Biofilmoverflatedekning av foreldrestammen, PAO-P47, men ikke lecA-mutanten på stålkuponger ble også hemmet av vekst i nærvær av enten isopropyl-beta-D-tiogalaktosid (IPTG) eller p-nitrofenyl-alfa-D-galaktosid ( NPG).Videre kan modne villtype biofilmer dannet i fravær av disse hydrofobe galaktosidene spres ved tilsetning av IPTG.I motsetning til dette hadde tilsetning av p-nitrofenyl-alfa-L-fucose (NPF) som har høy affinitet for P. aeruginosa LecB (PA-IIL) lektien ingen effekt på biofilmdannelse eller spredning.Planktonvekst av P. aeruginosa PAO1 var upåvirket av tilstedeværelsen av IPTG, NPG eller NPF, og stammen var heller ikke i stand til å bruke disse sukkerene som karbonkilder, noe som tyder på at de observerte effektene på biofilmdannelse skyldtes den konkurrerende hemmingen av LecA-ligand bindende.Lignende resultater ble også oppnådd for biofilmer dyrket under dynamiske strømningsforhold på stålkuponger, noe som tyder på at LecA bidrar til P. aeruginosa biofilmarkitektur under forskjellige miljøforhold.
En alfa-L-fucosidase (EC 3.2.1.51) som er i stand til å frigjøre t-fucosyl-resten fra sidekjeden til xyloglukan-oligosakkarider er påvist i bladene til Arabidopsis-planter.Dessuten ble en alfa-L-fucosidase med lignende substratspesifisitet renset fra kålblader (Brassica oleracea) for å gjengi et enkelt bånd på SDS-PAGE.To peptidsekvenser ble oppnådd fra dette proteinbåndet, og de ble brukt til å identifisere et Arabidopsis-gen som koder for en alfa-fucosidase som vi foreslår å kalle AtFXG1.I tillegg er det også funnet et Arabidopsis-gen med homologi med kjente alfa-L-fucosidaser, og vi foreslo å navngi det som AtFUC1.Både AtFXG1 og ATFUC1 ble heterologt uttrykt i Pichia pastoris-celler og alfa-L-fucosidase-aktivitetene utskilt til kulturmediet.Alfa-L-fucosidasen kodet av AtFXG1 var aktiv mot oligosakkaridene fra xyloglucan XXFG så vel som mot 2'-fucosyl-laktitol, men ikke mot p-nitrofenyl-alfa-L-fukopyranosid.Imidlertid var AtFUC1 heterologt uttrykt aktiv bare mot 2'-fucosyl-laktitol.Dermed må førstnevnte være relatert til xyloglukanmetabolisme.