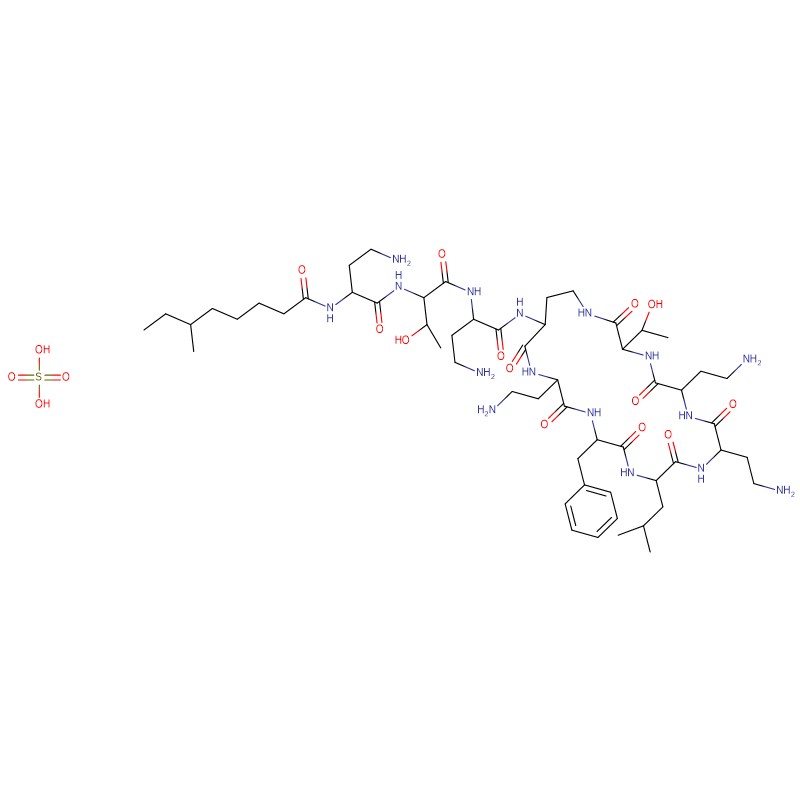
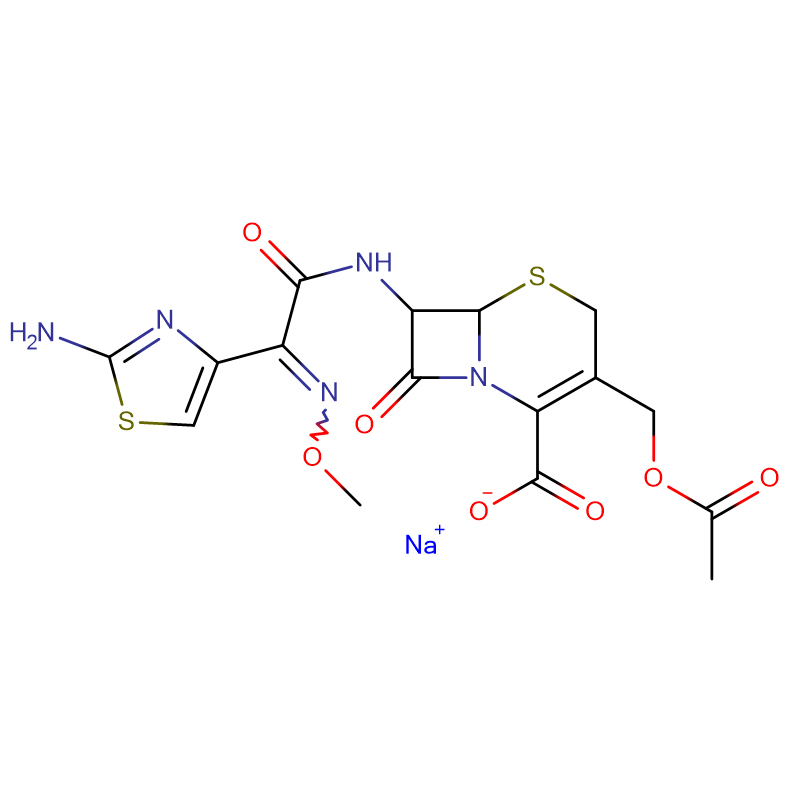
Polymyxin B sulfate CAS:1405-20-5 Hvitt pulver
| Katalognummer | XD90360 |
| Produktnavn | Polymyxin B-sulfat |
| CAS | 1405-20-5 |
| Molekylær formel | C55H96N16O13 · 2H2SO4 |
| Molekylær vekt | 1385,61 |
| Oppbevaringsdetaljer | 2 til 8 °C |
| Harmonisert tariffkode | 29419000 |
Produkt spesifikasjon
| Konklusjon | Samsvarer med USP35 |
| Tungmetaller | <20 ppm |
| pH | 5-7 |
| Identifikasjon | Væskekromatografi: samsvarer |
| Assay | 99 % |
| Utseende | hvitt pulver |
| Tap ved tørking | <6 % |
| Løselighet | Lett løselig i vann, lett løselig i etanol |
| Sulfat | 15,5 % - 17,5 % |
| Partikkelstørrelse | <30 µm |
| Spesifikk optisk rotasjon | -78° -90° |
| Fenylalanin | 9,0 %–12,0 % |
| Pyrogener | Oppfyller kravene |
| Sulfat aske | <0,75 % |
| Totalt levedyktig aerobic telling | <100 cfu/g |
| Potens | >6500 IE/mg |
ExPortal-proteinsekresjonsorganellen i Streptococcus pyogenes er et anionisk fosfolipidholdig membranmikrodomene beriket i Sec-translokoner og biogenesefaktorer for ettersekresjon.Polymyxin B binder seg til og forstyrrer ExPortal integritet, noe som resulterer i defekt sekresjon av flere giftstoffer.For å få innsikt i faktorer som påvirker ExPortal-organisasjonen, ble det utført en genetisk screening for å selektere for spontane polymyxin B-resistente mutanter som viser forbedret ExPortal-integritet.Resekvensering av hele genomet av 25 resistente mutanter avslørte fra én til fire mutasjoner per mutant genom gruppert primært innenfor et kjernesett med 10 gengrupper.Konstruksjon av mutanter med individuelle slettinger eller insersjoner viste at 7 kjernegener gir resistens og forbedret ExPortal-integritet gjennom tap av funksjon, mens 3 sannsynligvis skyldtes funksjonsforsterkning og/eller kombinatoriske effekter.Kjerneresistensgener inkluderer en transkripsjonsregulator av lipidbiosyntese, flere gener involvert i næringsinnsamling og en rekke gener involvert i stressresponser.To medlemmer av sistnevnte klasse fungerer også som nye regulatorer av den utskilte SpeB-cysteinproteasen.Analyse av den hyppigst isolerte mutasjonen, en enkelt nukleotidsletting i et spor av 9 påfølgende adeninrester i pstS, som koder for en komponent av en Pi-transportør med høy affinitet, antyder at denne sekvensen fungerer som en molekylær bryter for å lette stresstilpasning.Sammen antyder disse dataene eksistensen av en membranstressrespons som fremmer forbedret ExPortal-integritet og motstand mot kationiske antimikrobielle peptider.