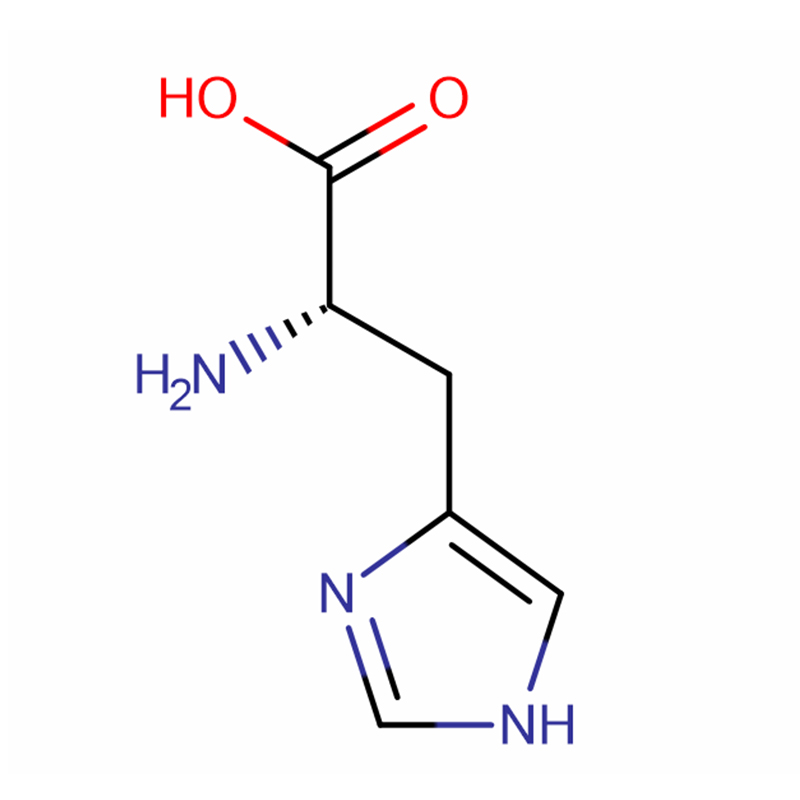
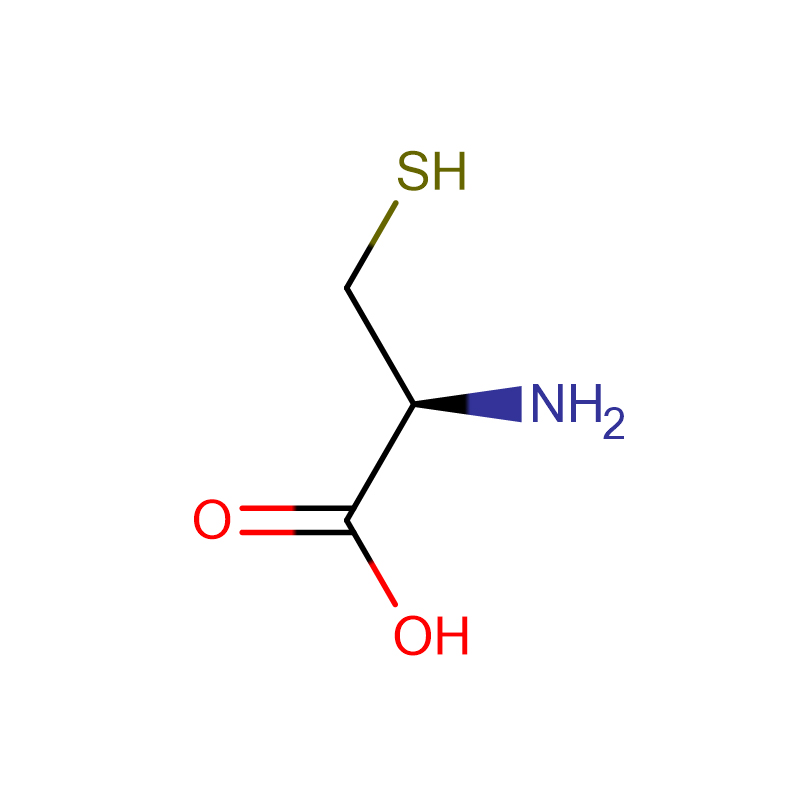
L-Histidin Cas: 71-00-1 98,5 % Hvite krystaller eller krystallinsk pulver
| Katalognummer | XD90301 |
| Produktnavn | L-Histidin |
| CAS | 71-00-1 |
| Molekylær formel | C6H9N3O2 |
| Molekylær vekt | 155,15 |
| Oppbevaringsdetaljer | Omgivende |
| Harmonisert tariffkode | 29332990 |
Produkt spesifikasjon
| Assay | 98,5 % min |
| Utseende | Hvite krystaller eller krystallinsk pulver |
| Karakter | USP39 |
| Spesifikk rotasjon | +12,6 ° til +14,0 ° |
| Identifikasjon | Infrarød absorpsjon |
| pH | 7,0 - 8,5 |
| SO4 | <=0,03 % |
| Fe | <=30 spm |
| Tap ved tørking | <=0,2 % |
| Rester ved tenning | <=0,1 % |
| Cl | <=0,05 % |
| Tungmetaller (PB) | <=15 spm |
| Beslektede forbindelser | Ikke mer enn 0,5 % av noen individuell urenhet er funnet;Ikke mer enn 2,0 % av totale urenheter er funnet |
de quadruplex-dannende G-rike sekvensene er ujevnt fordelt gjennom det menneskelige genomet.Deres berikelse i onkogene promotere og telomerer har skapt interesse for å målrette mot G-quadruplex (GQ) for en kreftbehandling.Her presenterer vi en kvantitativ analyse på konformasjonene og dynamikken til GQ-dannende sekvenser målt ved enkeltmolekylfluorescens.I tillegg relaterer vi disse egenskapene til GQ-målrettende ligander og G4 resolvase 1 (G4R1) proteinbinding.Resultatet vårt viser at både løkken (ikke-G-komponenter) lengde og sekvens bidrar til konformasjonen av GQ.Enkeltmolekylspor i sanntid avslører at foldedynamikken også avhenger av løkkesammensetningen.Vi demonstrerer at GQ-stabiliserende små molekyler, N-methyl mesoporphyrin IX (NMM), dens analog, NMP og G4R1-proteinet binder seg selektivt til den parallelle GQ-konformasjonen.Funnene våre peker på kompleksiteten til GQ-folding styrt av løkkelengden og sekvensen og hvordan GQ-konformasjonen bestemmer det lille molekylet og proteinbindingstilbøyeligheten.