L-Proline Cas: 147-85-3 99% Hvitt pulver
| Katalognummer | XD90293 |
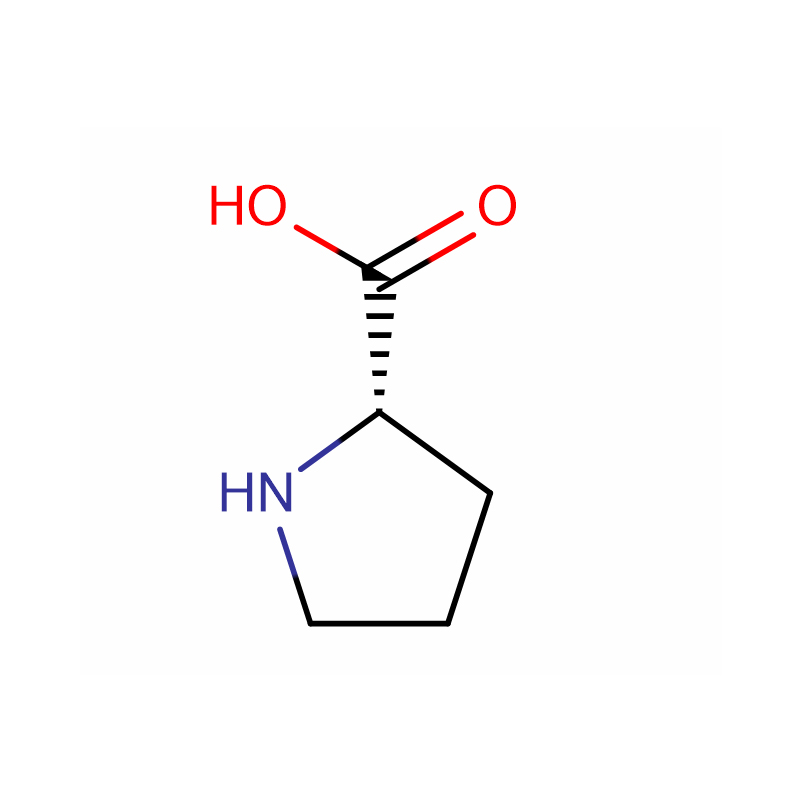
| Produktnavn | L-prolin |
| CAS | 147-85-3 |
| Molekylær formel | C5H9NO2 |
| Molekylær vekt | 115.13046 |
| Oppbevaringsdetaljer | Omgivende |
| Harmonisert tariffkode | 29339980 |
Produkt spesifikasjon
| Assay | 99 % min |
| Utseende | hvitt pulver |
| Spesifikk rotasjon | -84,5 til -86 |
| Tungmetaller | <15 ppm |
| AS | <1 ppm |
| Ph | 5,9 - 6,9 |
| SO4 | <0,050 % |
| Fe | <30 ppm |
| Tap ved tørking | <0,3 % |
| Rester ved tenning | <0,10 % |
| NH4 | <0,02 % |
| Cl | <0,050 % |
| Status for løsning | >98 % |
Å forstå metabolismen til den mikrobielle verten er avgjørende for utvikling og optimalisering av helcellebaserte biokatalytiske prosesser, da det dikterer produksjonseffektivitet.Dette gjelder spesielt for redoksbiokatalyse hvor metabolsk aktive celler brukes på grunn av kofaktor/kosubstrat-regenerasjonskapasiteten som er endogen i verten.Rekombinant Escherichia coli ble brukt for å overprodusere prolin-4-hydroksylase (P4H), en dioksygenase som katalyserer hydroksyleringen av fritt L-prolin til trans-4-hydroksy-L-prolin med a-ketoglutarat (a-KG) som kosubstrat.I denne helcellebiokatalysatoren gir sentral karbonmetabolisme det nødvendige cosubstratet a-KG, og kobler P4H biokatalytisk ytelse direkte til karbonmetabolisme og metabolsk aktivitet.Ved å bruke både eksperimentelle og beregningsbiologiske verktøy, slik som metabolsk konstruksjon og (13)C-metabolisk fluksanalyse ((13)C-MFA), undersøkte og kvantitativt beskrev vi den fysiologiske, metabolske og bioenergetiske responsen til helcellebiokatalysatoren til den målrettede biokonverteringen og identifiserte mulige metabolske flaskehalser for videre rasjonell baneutvikling. En E. coli-stamme med mangel på prolinnedbrytning ble konstruert ved å slette putA-genet som koder for prolinedehydrogenase.Helcellebiotransformasjoner med denne mutante stammen førte ikke bare til kvantitativ prolinhydroksylering, men også til en dobling av den spesifikke trans-4-L-hydroksyprolin (hyp) dannelseshastigheten, sammenlignet med villtypen.Analyse av karbonfluks gjennom sentral metabolisme av mutantstammen avslørte at den økte a-KG-etterspørselen etter P4H-aktivitet ikke forbedret den a-KG-genererende fluksen, noe som indikerer en tett regulert TCA-syklusoperasjon under forholdene som ble studert.I villtype-stammen forårsaket P4H-syntese og katalyse en reduksjon i biomasseutbytte.Interessant nok kompenserte ΔputA-stammen i tillegg det assosierte ATP- og NADH-tapet ved å redusere vedlikeholdsenergibehovet ved sammenlignbart lave glukoseopptakshastigheter, i stedet for å øke TCA-aktiviteten. PutA-knockouten i rekombinant E. coli BL21(DE3)(pLysS) ble funnet å være lovende for produktiv P4H-katalyse, ikke bare når det gjelder biotransformasjonsutbytte, men også når det gjelder hastighetene for biotransformasjon og prolinopptak og utbyttet av hyp på energikilden.Resultatene indikerer at ved en putA knockout, blir koblingen av TCA-syklusen til prolinhydroksylering via kosubstratet a-KG en nøkkelfaktorbegrensende og et mål for ytterligere å forbedre effektiviteten til a-KG-avhengige biotransformasjoner.