IPTG (isopropyl-β-D-tiogalaktosid) er en analog av β-galaktosidasesubstrat, som er svært induserbart.Under induksjon av IPTG kan induktoren danne et kompleks med repressorproteinet, slik at konformasjonen til repressorproteinet endres, slik at det ikke kan kombineres med målgenet, og målgenet uttrykkes effektivt.Så hvordan skal konsentrasjonen av IPTG bestemmes under eksperimentet?Er jo større jo bedre?
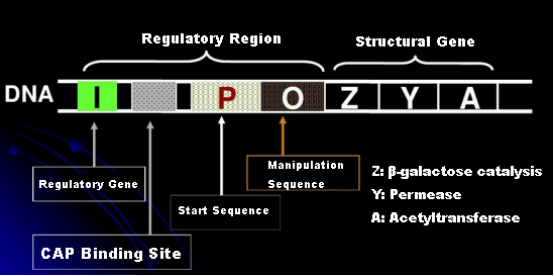
La oss først forstå prinsippet for IPTG-induksjon: E. colis laktoseoperon (element) inneholder tre strukturelle gener, Z, Y og A, som koder for henholdsvis β-galaktosidase, permease og acetyltransferase.lacZ hydrolyserer laktose til glukose og galaktose, eller til allolaktose;lacY lar laktose i miljøet passere gjennom cellemembranen og kommer inn i cellen;lacA overfører acetylgruppen fra acetyl-CoA til β-galaktosid, noe som innebærer å fjerne toksisk effekt.I tillegg er det en operasjonssekvens O, en startsekvens P og et regulatorgen I. I-genkoden er et repressorprotein som kan binde seg til posisjon O i operatorsekvensen, slik at operonet (meta) blir undertrykt og slått av.Det er også et bindingssete for katabolisk genaktivatorprotein-CAP-bindingssete oppstrøms for initieringssekvensen P. P-sekvensen, O-sekvensen og CAP-bindingssetet utgjør sammen den regulatoriske regionen til lac-operonet.De kodende genene til de tre enzymene reguleres av den samme regulatoriske regionen for å oppnå det koordinerte uttrykket av genprodukter.
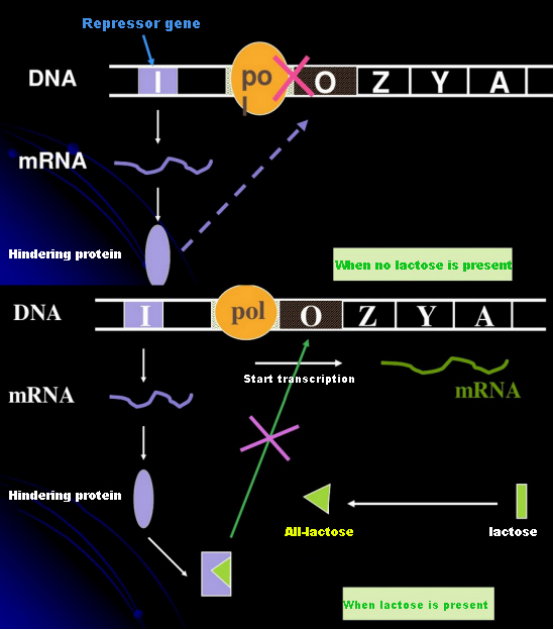
I fravær av laktose er lac-operonet (meta) i en tilstand av undertrykkelse.På dette tidspunktet binder lac-repressoren uttrykt av I-sekvensen under kontroll av PI-promotersekvensen til O-sekvensen, som hindrer RNA-polymerase i å binde seg til P-sekvensen og hemmer transkripsjonsinitiering;når laktose er tilstede, kan lac operon (meta) induseres. I dette operon (meta) systemet er ikke den virkelige induktoren laktose i seg selv.Laktose kommer inn i cellen og katalyseres av β-galaktosidase for å bli omdannet til allolaktose.Sistnevnte, som et indusermolekyl, binder seg til repressorproteinet og endrer proteinkonformasjonen, noe som fører til dissosiasjon av repressorproteinet fra O-sekvensen og transkripsjon.Isopropyltiogalaktosid (IPTG) har samme effekt som allolaktose.Det er en veldig kraftig induser, som ikke metaboliseres av bakterier og er veldig stabil, så den er mye brukt i laboratorier.
Hvordan bestemme den optimale konsentrasjonen av IPTG?Ta E. coli som et eksempel.
Den genetisk konstruerte E. coli BL21-stammen inneholdende den positive rekombinante pGEX (CGRP/msCT) ble inokulert i LB flytende medium inneholdende 50μg·mL-1 Amp, og dyrket over natten ved 37°C.Ovennevnte kultur ble inokulert i 10 flasker med 50mL ferskt LB flytende medium inneholdende 50μg·mL-1 Amp i et forhold på 1:100 for ekspansjonskultur, og når OD600-verdien var 0,6~0,8, ble IPTG tilsatt til sluttkonsentrasjonen.Det er 0,1, 0,2, 0,3, 0,4, 0,5, 0,6, 0,7, 0,8, 0,9, 1,0 mmol·L-1.Etter induksjon ved samme temperatur og samme tid ble 1 ml av bakterieoppløsningen tatt fra den, og bakteriecellene ble samlet ved sentrifugering og utsatt for SDS-PAGE for å analysere påvirkningen av forskjellige IPTG-konsentrasjoner på proteinekspresjon, og deretter velg IPTG-konsentrasjonen med det største proteinuttrykket.
Etter eksperimenter vil det vise seg at konsentrasjonen av IPTG ikke er så stor som mulig.Dette er fordi IPTG har en viss toksisitet for bakterier.Overskridelse av konsentrasjonen vil også drepe cellen;og generelt sett håper vi at jo mer løselig protein som uttrykkes i cellen, jo bedre, men i mange tilfeller når konsentrasjonen av IPTG er for høy, vil det dannes en stor mengde inklusjon.Kroppen, men mengden løselig protein gikk ned.Derfor er den mest passende IPTG-konsentrasjonen ofte ikke jo større jo bedre, men jo lavere konsentrasjon.
Formålet med induksjon og dyrking av genetisk konstruerte stammer er å øke utbyttet av målproteinet og redusere kostnadene.Ekspresjonen av målgenet påvirkes ikke bare av stammens egne faktorer og ekspresjonsplasmidet, men også av andre ytre forhold, som konsentrasjonen av induktoren, induksjonstemperaturen og induksjonstiden.Derfor, generelt, før et ukjent protein uttrykkes og renses, er det best å studere induksjonstid, temperatur og IPTG-konsentrasjon for å velge de passende forholdene og oppnå de beste eksperimentelle resultatene.
Innleggstid: 31. desember 2021

